الشيخوخة الخلوية والتقدم في العمر - ما يمكنك فعله
العديد من الناس لديهم معرفة جزئية بكلمة "الشيخوخة" ويعتبرون المصطلح مرادفًا للشيخوخة. بعد كل شيء، فإن جذر الكلمة هو "sen-" الذي يعني قديم وهو أيضًا جذر كلمة "senile" التي تعني بالطبع ما يميز الشيخوخة.
لكن عندما يتحدث علماء الأحياء عن الشيخوخة الخلوية، فإنهم لا يقصدون بالضبط الشيخوخة بالطريقة التي يفكر بها الناس عادةً في هذه العملية. اعتمادًا على نوع النسيج، تعيش الخلايا في جسمك لفترات زمنية متفاوتة. تعيش خلايا الدم البيضاء حوالي 13 يومًا، مقارنةً بـ 120 يومًا تعيشها خلايا الدم الحمراء. تعيش الخلايا الدهنية حوالي ثماني سنوات وتعيش الخلايا المعوية (باستثناء البطانة) ما يقرب من 16 عامًا.
عندما تصل خلايا الجسم إلى نهاية حياتها الطبيعية، تموت موتًا مبرمجًا مسبقًا عبر عملية تُسمى الاستماتة (تُنطق "أ-بوب-تُو-سيس") والتي تهدف إلى عدم إلحاق الضرر بأي خلايا مجاورة. أو ربما تكون الخلية صغيرة أو في منتصف العمر وتتعرض للتلف بطريقة ما. في كثير من الأحيان يمكن إصلاح هذا التلف وتستأنف الخلية وظيفتها الطبيعية. إذا كان الضرر شديدًا للغاية، فإن الخلية تخضع مرة أخرى لعملية الاستماتة وتُدمر.
عادةً ما تخضع الخلايا للانقسام المستمر، سواء لاستبدال الخلايا التي ماتت أو للمساعدة في الإصلاح، كما في نمو خلايا جلد جديدة لإغلاق الجرح. أحيانًا، عندما يتضرر الحمض النووي الخلوي، تصبح هذه الخلايا سرطانية وتندفع إلى التكاثر غير المنضبط.
فهم الشيخوخة الخلوية
الطريقة الأخرى التي تستجيب بها الخلايا للتلف الذي لا يكون شديدًا لدرجة تحفيز الموت المبرمج هي أن تصبح شيخوخية. وهذا يعني أنه بدلاً من الانغماس في تكاثر غير منضبط، فإنها ببساطة تتوقف عن الانقسام وتنتهي دورة الخلية الطبيعية. يعتقد العديد من العلماء أن هذه القدرة على الدخول في حالة شيخوخة هي طريقة الجسم لمحاولة منع هذه الخلايا التالفة من أن تصبح سرطانية.
على الرغم من أن هذه الخلايا الشائخة لا تنقسم بنشاط، إلا أنها ليست ميتة بأي حال من الأحوال. لا تزال الخلايا الشائخة نشطة للغاية من الناحية الأيضية، حيث تفرز مجموعة من البروتينات والجزيئات الأخرى التي تُعرف باسم SASP (الظاهرة الإفرازية المرتبطة بالشيخوخة) والتي يمكن أن تسبب الالتهاب. بهذه الطريقة، يمكن للخلايا الشائخة أن تُشير إلى الخلايا المناعية لتأتي وتساعد في تنظيف الأضرار والمساعدة في إصلاح الأنسجة. حتى الآن، يبدو أن هذا شيء جيد.
لكن على الرغم من أن SASP يساعد في إصلاح الأنسجة، إلا أن بعض البروتينات والجزيئات التي قد تشكل هذا المصفوفة يمكن أن يكون لها آثار ضارة. مع تقدمك في العمر، تبدأ الخلايا الشائخة في التراكم في الجسم، بما في ذلك الدماغ. تنتج جميع هذه الخلايا الشائخة جزيئات وبروتينات SASP الالتهابية، والتي يمكن أن تسرع في الواقع من عملية الشيخوخة نفسها وتفاقم الحالات المرتبطة بالعمر مثل أمراض القلب والزهايمر. بالإضافة إلى ذلك، يمكن أن يؤدي التعرض المستمر لـ SASP إلى تحفيز الشيخوخة في الخلايا السليمة في الأصل.
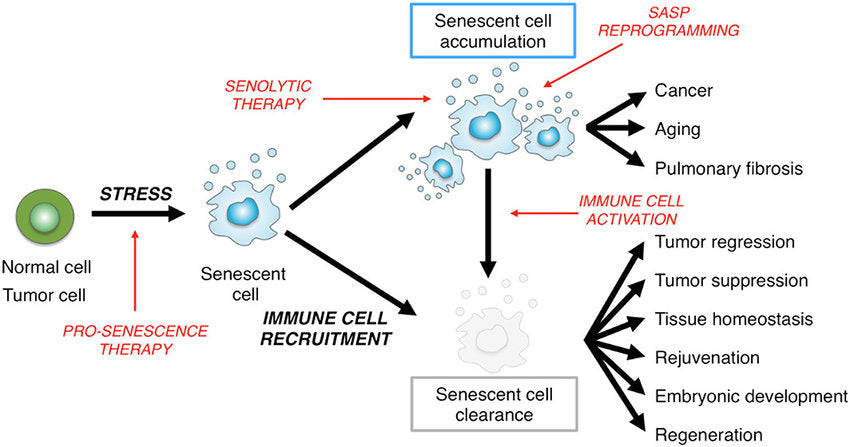
إزالة الخلايا الشائخة من الجسم
ماذا لو كان بالإمكان إزالة هذه الخلايا الشائخة من الجسم، إلى جانب البروتينات والجزيئات الالتهابية السامة التي تنتجها؟ لقد تم بالفعل إثبات أنه في نموذج فأر لمرض التنكس العصبي، أن إزالة الخلايا الشائخة قد أظهرت تحسنًا في وظائف الدماغ لدى هذه الحيوانات.
لكن ما لم يكن معروفًا هو هذا: هل يمكن أن يساعد إزالة الخلايا الشائخة من الجسم في تخفيف شيخوخة الدماغ والتدهور المعرفي الذي يأتي مع الشيخوخة الطبيعية؟ حاولت الأبحاث الحديثة التي قادها علماء في مركز روبرت وأرلين كوغود للشيخوخة في مايو كلينك، والتي نُشرت في عدد 21 يناير 2021 من مجلة Aging Cell، الإجابة على هذا السؤال.
مرة أخرى لجأ الباحثون إلى نموذج الفأر في محاولتهم للإجابة على هذا السؤال. استخدم الفريق فئرانًا معدلة وراثيًا. يتم تربية هذه الفئران خصيصًا لتكون جزءًا من الأبحاث الطبية ويتم إدخال الحمض النووي "الأجنبي" في نواة بويضة فأر مخصبة. عندما يتطور الفأر، يصبح الحمض النووي الأجنبي جزءًا من كل خلية. مكنت هذه الفئران المرباة خصيصًا الفريق من استخدام دواء يقتل بشكل انتقائي الخلايا التي تعبر عن P16ink4a، وهو بروتين متورط في تنظيم دورة الخلية ويعمل على إبطاء انقسام الخلايا.
مع تقدم الكائنات الحية في العمر، يزداد تعبير بروتين P16ink4a. يساعد هذا الجسم في تقليل تكاثر الخلايا الجذعية مما يقلل من خطر الإصابة بالسرطان، ولكنه في الوقت نفسه يجعل الجسم عرضة لتأثيرات بروتينات SASP والجزيئات الأخرى التي تنتجها هذه الخلايا الشائخة. نظرًا لأن هذا النهج لا يمكن أن يضمن تدمير جميع الخلايا الشائخة، استخدم الباحثون أيضًا مزيجًا من الأدوية لاستهداف الخلايا الشائخة المتبقية في الفئران. استخدم الباحثون عدة مجموعات من الفئران المسنة (25 إلى 29 شهرًا) بالإضافة إلى مجموعة أصغر للمقارنة.
كانت النتائج واضحة تمامًا: إزالة الخلايا الشائخة في أجسام وأدمغة الفئران المسنة أدت إلى تخفيف الضعف الإدراكي المرتبط بالعمر، وخاصة خلل الذاكرة المكانية. كما أظهرت النتائج انخفاضًا في مؤشرات الشيخوخة في الخلايا العصبية للحُصين، وهو جزء من الدماغ يرتبط تحديدًا بالذاكرة والإدراك ويخضع للتدهور التدريجي مع التقدم في العمر.
كما أن إزالة الخلايا الشائخة قللت بشكل كبير من مؤشرات التهاب الدماغ التي ارتبطت بوضوح بالتدهور المعرفي المرتبط بالعمر. بينما يؤكد المؤلفون أنه لا يزال من غير الواضح تمامًا كيف تؤثر شيخوخة الخلايا على شيخوخة الدماغ، إلا أن نتائج دراستهم تظهر بشكل قاطع أن العلاجات الموجهة لإزالة الخلايا الشائخة توفر نهجًا واعدًا لتجديد شباب الدماغ المتقدم في العمر وكذلك تحسين الذاكرة لدى كبار السن.
NAD والشيخوخة الخلوية
كما أبلغنا في مقالات سابقة، فإن NAD (نيكوتيناميد أدينين دينوكليوتيد) الذي يعمل في الجسم كإنزيم مساعد أو عامل مساعد مهم، والذي ينخفض بشكل طبيعي مع التقدم في العمر، قد أظهر نتائج واعدة جدًا في مجال مكافحة الشيخوخة، بما في ذلك مجال شيخوخة الخلايا. أظهرت الأبحاث من جامعة كوينزلاند، أستراليا، التي نُشرت في عدد 18 فبراير 2020 من مجلة Cell Reports، أن جرعات منخفضة نسبيًا من NMN كانت فعالة في استعادة جودة البيض في الفئران المسنة. وعلى الرغم من أن البحث الأولي أُجري على الفئران، فإن الباحثين متفائلون جدًا بشأن الوعد الذي تحمله هذه العوامل في علاج خصوبة الإنسان.
أظهر الباحثون بشكل قاطع في نماذج الفئران أن العلاج بـ NAD يمنح تأثيرات قوية مضادة للشيخوخة على النظام العصبي الوعائي، بما في ذلك تحسين الأداء المعرفي. علاوة على ذلك، أظهر علاج الخلايا الوعائية من الفئران المسنة (العمر البيولوجي لفئران تبلغ من العمر 24 شهرًا يقابل تقريبًا عمر البشر البالغين 60 عامًا) التي تم علاجها بـ NMN لمدة خمسة أيام استعادة مستويات NAD الشبابية وعودة وظيفة الميتوكوندريا. لقد ناقشنا أيضًا في مكان آخر أن NAD يلعب دورًا حاسمًا في الأداء الأمثل للسيرتوينات (تُنطق "سير-تو-إنز")، وهي عائلة من البروتينات المعروفة بجينات طول العمر، التي تنظم الشيخوخة الخلوية.
على الرغم من أن ممارسات مثل تقييد السعرات الحرارية والصيام قد أظهرت زيادة مستويات NAD، إلا أن تناول مكمل NAD+ عالي الجودة يوميًا هو الطريقة الأكثر موثوقية وعملية وفعالية للتأكد من تلبية احتياجاتك من NAD.
يمكنك العثور على معلومات كاملة عن جميع مكملات NAD+ عالية الجودة هنا، بما في ذلك NAD+ وسابقه NMN. عند تناولها يوميًا، ستزيد مكملات NAD+ من مستويات هذا الإنزيم المساعد القوي وتوفر لك أفضل حماية ضد آثار عملية الشيخوخة، بما في ذلك الآثار الضارة للشيخوخة على صحتك العقلية.
المراجع:
1. Ogrodnik, M., Evans, S.A., Fielder, E., Victorelli, S., Kruger, P., Salmonowicz, H., Weigand, B.M., Patel, A.D., Pirtskhalava, T., Inman, C.L., Johnson, K.O., Dickinson, S.L., Rocha, A., Schafer, M.J., Zhu, Y., Allison, D.B., von Zglinicki, T., LeBrasseur, N.K., Tchkonia, T., Neretti, N., Passos, J.F., Kirkland, J.L. and Jurk, D. (2021), إزالة الخلايا الشائخة من الجسم بالكامل يخفف من التهاب الدماغ المرتبط بالعمر وضعف الإدراك في الفئران. Aging Cell, 20: e13296. https://doi.org/10.1111/acel.13296.
٢. Bertoldo et al. NAD Repletion Rescues Female Fertility during Reproductive Aging. Cell Reports, ٢٠٢٠؛ ٣٠ (٦): ١٦٧٠ DOI: 10.1016/j.celrep.2020.01.058
Kiss T & Nyúl-Tóth Á وآخرون. تعزيز مكملات أحادي نيوكليوتيد النيكوتيناميد (NMN) لتجديد الأوعية الدموية العصبية في الفئران المسنة: البصمة النسخية لتفعيل SIRT1، وحماية الميتوكوندريا، والتأثيرات المضادة للالتهابات والمضادة للاستماتة. Geroscience. 2020 Apr;42(2):527-546. doi: 10.1007/s11357-020-00165-5. Epub 2020 Feb 13. PMID: 32056076; PMCID: PMC7206476.
3. Tarantini S & Valcarcel-Ares MN et al. مكملات أحادي نيوكليوتيد النيكوتيناميد (NMN) تنقذ وظيفة البطانة الوعائية الدماغية الدقيقة واستجابات الاقتران العصبي الوعائي وتحسن الوظيفة الإدراكية في الفئران المسنة. Redox Biol. يونيو 2019؛ 24:101192. doi: 10.1016/j.redox.2019.101192. نُشر إلكترونيًا في 10 أبريل 2019. PMID: 31015147; PMCID: PMC6477631.
4. Hou Y, Lautrup S, Cordonnier S, وآخرون. إضافة NAD+ تطبيع ميزات مرض الزهايمر. وقائع الأكاديمية الوطنية للعلوم فبراير 2018، 115 (8) E1876-E1885؛ DOI:10.1073/pnas.1718819115.
5. Kiss T, Giles C, Tarantini S. et al. Nicotinamide mononucleotide (NMN) supplementation promotes anti‐aging miRNA expression profile in the aorta of aged mice, predicting epigenetic rejuvenation and anti‐atherogenic effects. FASEB Journal 18 April 2020 https://doi.org/10.1096/fasebj.2020.34.s1.04769.
5. كيس ت، جايلز سي، تارانتيني س وآخرون. يعزز مكمل نيكوتيناميد مونونوكليوتيد (NMN) من التعبير الجيني للـ miRNA المضاد للشيخوخة في الشريان الأورطي للفئران المسنة، مما يتنبأ بتجديد جيني مضاد للشيخوخة وتأثيرات مضادة لتصلب الشرايين. مجلة FASEB 18 أبريل 2020 https://doi.org/10.1096/fasebj.2020.34.s1.04769.

